特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)以肺上皮细胞衰老和间质纤维化为特征,中位生存率低。虽然IPF的确切机制尚不清楚,但越来越多的证据表明,IPF可能是由于氧化应激导致的肺泡干细胞DNA损伤和保护机制受损所致。
多种细胞和遗传因素,包括染色体端粒稳定所需的因素,与散发性IPF有关。端粒酶亚单位基因突变关联家族性IPF,与肺泡上皮2型(AEC2)干细胞衰老和向肌成纤维细胞分化有关。端粒功能障碍是衰老相关疾病的一个潜在原因,它是由shelterin蛋白和端粒酶的突变引起的,这些突变保护细胞免受端粒DNA损伤反应(DDR)和衰老的影响。
shelterin蛋白组分、端粒重复结合因子2(TRF2)或端粒酶基因的遗传突变,可以诱导IPF,而端粒酶催化亚单位TERT的转基因表达可能会减轻这种疾病。通过与遗传因素相互作用,环境压力源包括破坏DNA的抗生素博莱霉素、电离辐射(IR)和活性氧都可以引起IPF。博莱霉素也会导致端粒缩短,但相关的机制仍不明确。
FBW7通过引导一些原癌蛋白降解来调节癌细胞增殖,但FBW7是人类癌症中最常见的突变基因之一。Fbw7失活导致胰腺、骨髓造血组织和睾丸生精组织中的组织干细胞扩张,其机制尚不清楚。
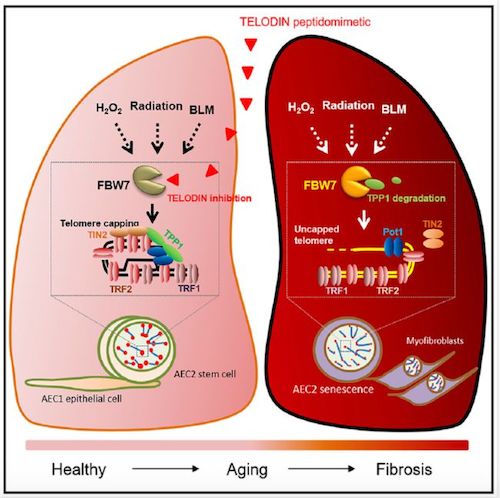
2020年10月20日,杭州师范大学刘俊平团队在Cell Metabolism杂志上发表了文章FBW7 Mediates Senescence and Pulmonary Fibrosis through Telomere Uncapping,发现肿瘤抑制蛋白、E3泛素蛋白连接酶FBW7可以降解端粒蛋白TPP1,促使端粒暴露和缩短,癌症或干细胞老化,以及肺纤维化;利用合成的拟肽类药物靶向FBW7可以保护端粒、防止端粒“脱帽”和缩短,抵消衰老过程。

研究人员利用荧光标记和显微成像技术,对肿瘤、小鼠肺上皮干/祖细胞和人肺正常上皮细胞中的蛋白激酶和泛素E3连接酶进行了检测,发现FBW7通过加速TPP1的转换,触发端粒的解封和缩短而介导细胞衰老。在小鼠AEC2干细胞中,研究人员表明Fbw7基因敲除(KO)以TPP1稳定性依赖的方式阻止博莱霉素或IR诱导的端粒解封、肺衰老和纤维化。此外,他们还证明了一种小肽类似物能够特异性地抑制FBW7与TPP1的结合,从而减弱端粒的去包裹作用。
筛选与FBW7不同区域互补的合成肽表明,抑制端粒功能不全的短肽(TELODIN)能阻止小鼠TPP1降解、端粒缩短、肺泡干细胞衰老和肺纤维化。
30多年来,压力如何引发端粒缩短或肺纤维化一直是个谜。这项研究展示了氧化应激如何触发端粒封顶蛋白TPP1降解,导致端粒蛋白帽丢失,端粒DNA暴露,从而导致端粒DNA断裂和缩短,细胞衰老和转分化,以及肺纤维化。此外,研究人员还发现一个8-聚体小肽可以阻止TPP1降解、端粒解封、端粒延长和肺干细胞动员,从而增强正常呼吸功能,抵抗应激性衰老和纤维化。
总的来说,该研究通过解决染色体端粒解封或“脱帽”的机制问题,确定了一种新的治疗目标,可以增强小鼠的呼吸功能,防止环境压力导致的应激性肺早衰和纤维化。该发现主要是通过对端粒解封机制的突破,从而为揭示肺纤维化的发病机制及其干预提供了途径;阐明了压力诱导的肺上皮干细胞衰老和纤维化的关键机制,为衰老相关疾病的干预铺平了一个全新的道路。
第一作者单位为杭州师范大学,由王丽辉博士、陈如萍博士、李果博士作为共同第一作者完成的,其他作者有王志国博士、刘军博士、梁颖硕士,通讯作者刘俊平教授。