J Biol Chem | 丛羽生教授团队报道人源UFSP1是具有活性和底物特异性的犹素化修饰蛋白酶
1
2022年6月,我院丛羽生教授团队在学术期刊 Journal of Biological Chemistry上发表题为“Human UFSP1 translated from an upstream near-cognate initiation codon functions as an active UFM1-specific protease”的研究成果。该研究发现人源UFSP1是从CUG密码子起始翻译,其翻译产物是具有活性和底物特异性的犹素化修饰蛋白酶。论文被JBC期刊主编重点推荐(Editors' Picks),并为该论文发表评论文章 (JBC EDITORS’ PICK HIGHLIGHT by Lin et al, J. Biol. Chem. (2022) 298(10) 102431)。
UFM1修饰(又称Ufmylation或犹素化修饰)是最新鉴定的一种类泛素化修饰,由UFM1特异性激活酶(E1)、结合酶(E2)和连接酶(E3)催化活化的UFM1分子共价连接到底物蛋白的赖氨酸残基上;去修饰酶UfSP(Ufm1-specific protease)发挥着活化UFM1前体分子(pro-UFM1)以及去除底物蛋白UFM1修饰的作用。
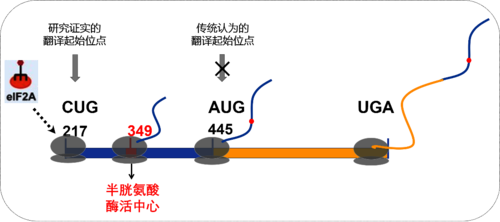
绝大多数生物的基因组中发现有两个犹素化修饰的去修饰酶基因UfSP1和UfSP2。一直以来, 学术界认为在人的细胞中UfSP2发挥着活化UFM1前体分子(pro-UFM1)和去除底物蛋白犹素化修饰的作用;而UfSP1则是不表达或无活性。其原因是以传统认识的mRNA中第一个AUG为翻译起始密码子的情况下,UfSP2基因编码的蛋白具有完整的蛋白酶活性结构域,而UfSP1基因编码的蛋白则缺少此关键催化活性结构域。在实验中,研究人员注意到一个有趣的现象:在人源细胞中敲除UfSP2基因时,能检测到细胞内犹素化修饰的显著升高。这与普遍认为的“在人的细胞中只有一个具有活性的犹素化修饰的去修饰酶UFSP2” 是相悖的。针对这一现象,梁千博士等研究人员通过基因编辑、蛋白纯化、犹素化修饰实验等系统的研究发现:人源UfSP1的翻译起始密码子并不是传统认为的AUG,而是更上游的non-AUG密码子CUG; 人源UfSP1蛋白包含完整的蛋白酶催化活性结构域,具有去修饰酶活性和底物特异性(图1)。
2
图1. 人源UfSP1翻译示意图
该研究成果更正了当前对绝大多数生物(除小鼠和大鼠外)UfSP1的认识,填补犹素化修饰反应环节的空白,同时也为non-AUG翻译起始理论提供了更多科学依据。
丛羽生团队梁千博士为文章的第一作者, 浙江省衰老与癌变生物学重点实验室丛羽生教授为本文的通讯作者。该研究受国家自然科学基金重点项目(丛羽生)和面上项目(梁千)的资助。
丛羽生 团队
原文链接 https://www.sciencedirect.com/science/article/pii/S0021925822004562
评论文章链接(Editors' Pick Highlight)https://www.sciencedirect.com/science/article/pii/S0021925822008742