第一作者:张鑫、辛吉瑀、王志国
通讯作者:徐晓玲
发表期刊:mBio
期刊 5-Year Impact Factor:7.786
通讯单位:杭州师范大学 基础医学院
论文DOI:https://doi.org/10.1128/mbio.03233-22
(一)研究背景
3-羟基丙酸(3-hydroxypropionate,3-HP)是一种重要的化学中间体,用来合成丙烯酸、丙二酸和1,3-丙二醇等众多平台化合物,被称为世界上最具开发潜力的化工产品之一。3-HP的化学合成能耗高、污染大、成本高、效率较低且副产品多。生物合成法制备3-HP逐渐成为国际上最瞩目的研究方向之一,如以谷物类碳水化合物生产3-HP,利用转基因工程菌转化甘油、丙酸等底物来生产3-HP等。然而,目前已研究过的十余种生物合成途径中,只有丝状不产氧光合细菌中存在的3-HP循环是唯一利用自养方式进行的,具有不可比拟的优势。3-HP循环是自然界6种二氧化碳固定途径中新发现的一类自养途径,具有与其他传统固碳途径显著不同的鲜明特点:它是一个双循环偶联的代谢过程,通过两个循环充分利用产物和中间物;整个循环涉及19步化学反应,但只需13种酶完成催化,几个多功能酶构成一个简洁高效的催化体系,这在其他自养途径中并不常见。
将催化3-HP循环前两步反应的关键酶——乙酰辅酶A羧化酶(ACCase)和丙二酰辅酶A还原酶(MCR)重组构建为丙二酰辅酶A途径,已在大肠杆菌、酵母等细胞中实现3-HP的生物合成。然而,由于这两个重组酶在细胞中表达水平和催化活性的不平衡,所有包含丙二酰辅酶A途径的细胞合成3-HP的产量都较低,严重制约了3-HP的生物合成及其工业应用。作为催化丙二酰辅酶A转化为3-HP的关键酶,MCR全长1229个氨基酸,理论分子量为135 kD。MCR的N端和C端结构域分别具有醇脱氢酶和醛脱氢酶的催化活性,在3-HP的合成中发挥着关键催化作用。然而,目前全长MCR结构还没有被报道,其N端与C端结构域之间通过何种方式连接,生理状态下同源二聚体的拼装组合方式等都不清楚。此外,对MCR局部结构的研究依然无法阐明MCR整体的底物结合、催化和中间产物的转运机制,极大地限制了对MCR催化机理的理解及其在3-HP合成中的应用。
(二)成果简介
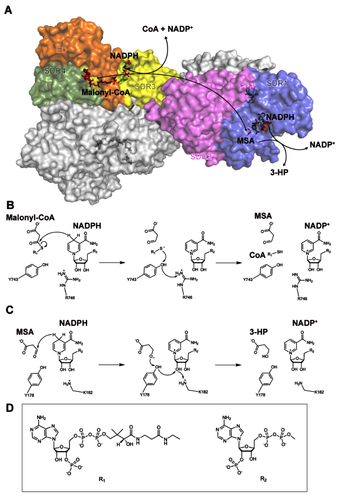
2023年6月6日,杭州师范大学基础医学院徐晓玲课题组在微生物领域权威期刊mBio(中科院升级版一区TOP期刊)上在线发表了题为“Structural basis of a bi-functional malonyl-CoA reductase (MCR) from the photosynthetic green non-sulfur bacterium Roseiflexus castenholzii”的研究成果。文章首次报道了来自光合玫瑰菌Roseiflexus castenholzii全长MCR(RfxMCR)3.35埃分辨率的冷冻电镜结构,及其N和C端结构域结合辅因子NADP+和中间产物丙二酸半醛(MSA)在2.0埃和2.3埃分辨率的X-射线晶体结构。研究发现,全长RfxMCR是由两个相互交叉的单体组成的同源二聚体,每个亚单位包含四个串联排列的短链脱氢酶/还原酶(SDR)结构域和一个额外的结构域(ED)组成。每个SDR结构域由七个平行的β折叠和两侧围绕的α-螺旋结构组成典型的Rossman折叠构象。在同源二聚体的交叉处,发现了N端和C端结构域连接处折叠形成两股反向平行的α-螺旋(G573WAESL578),推翻了此前关于MCR同源二聚体以相同方向排列的假设模型。
图1 全长丙二酰辅酶A还原酶(RfxMCR)的冷冻电镜结构
图2 丙二酰辅酶A还原酶N端和C端结合辅因子和中间产物的高分辨率晶体结构、催化位点的构象变化和活性测定
综合对N端和C端结构域与反应中间物复合物高分辨率的晶体结构、催化活性分析和全长MCR的分子动力学模拟,揭示了双功能酶RfxMCR选择底物、结合反应中间物和催化3-HP生成的分子机制。催化反应起始于RfxMCR的C端,NADPH烟酰胺基团的氢对丙二酰辅酶A(M-CoA)的羰基C3原子发起亲核攻击,导致S-C键断裂,生成MSA、CoAS-和NADP-。随后,CoAS-通过Tyr743羟基和Arg746胍基进行去质子化;去质子化的Arg746又可以被周围的溶剂还原。在第二步还原反应中,中间产物丙二酸半醛(MSA)进入RfxMCR的N端,N端的Thr165通过与C3羰基氧形成氢键来稳定反应中间体MSA,随后NADPH烟酰胺基团的氢对MSA的C3原子发起亲核攻击,反应生成的MSA阴离子通过从Tyr178羟基上提取一个质子而被质子化,形成3-HP。总体来说,RfxMCR催化M-CoA生产MSA,随后MSA转化为3-HP,整个过程共完成2步还原反应,消耗2分子NADPH。此工作首次揭示了MCR全长的结构特征和催化机制,为基于结构的酶改造、丙二酰辅酶A途径的合成生物学应用提供了理论依据,对3-HP的绿色合成具有重要指导意义。
图3 双功能丙二酰辅酶A还原酶催化丙二酰辅酶A生成3-羟基丙酸的分子机制。
(三)作者简介
杭州师范大学为该论文的第一研究单位,基础医学院徐晓玲教授为通讯作者,2022级生物学博士生张鑫、青年教师辛吉瑀和副教授王志国为共同第一作者,该工作受国家自然科学基金、浙江省自然科学基金杰出青年项目的资助。
论文链接:https://journals.asm.org/doi/10.1128/mbio.03233-22