第一作者:吴文萍
通讯作者:徐晓玲
发表期刊:Structure
通讯单位:杭州师范大学基础医学院
论文DOI:https://doi.org/10.1016/j.str.2024.10.014
(一)成果简介
2024年11月4日,杭州师范大学徐晓玲教授课题组在Structure期刊(中科院升级版二区)发表了题为“Crystal structure of the alternative complex III from the phototrophic bacterium Chloroflexus aurantiacus” 的研究论文,报道了绿色非硫细菌C. aurantiacus替代复合物III(CaACIIIp)的晶体结构。本研究以膜蛋白ACIII为例,对比了X射线晶体学和单颗粒冷冻电镜方法在测定生物大分子结构方面的异同,强调了使用多种结构测定技术来全面了解生物大分子构象稳定性和灵活性的价值。
(二)引言
在生物体能量代谢过程中,氧化磷酸化和光合磷酸化利用电子在供体和受体之间传递所产生的跨膜质子动力势驱动ATP的合成,为生命活动提供能量。在光合和氧化磷酸化过程中,电子传递和ATP的合成通过跨膜质子动力势偶联在一起,质子泵发挥着关键的作用。呼吸链有3种类型的质子泵(复合体I、III和IV);光合电子传递链只有细胞色素bc1/b6f复合体1个质子泵。因此,复合体III(在线粒体和细菌中为bc1,叶绿体和蓝藻中为b6f)是光合和呼吸电子传递链中共有的组分,都具有氢醌:电子受体氧化还原酶的活性,在偶联电子传递和质子跨膜转运中发挥着不可或缺的作用。
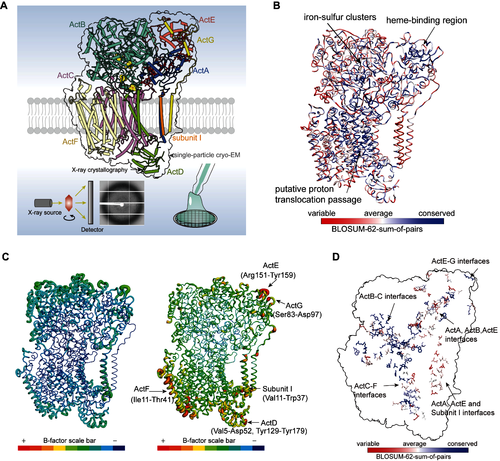
近年来,一种全新的电子载体蛋白复合体——替代复合体III(Alternative Complex III,ACIII)在多种微生物的光合和呼吸电子传递链中被发现。尽管该复合体的组成和结构与传统复合体III有显著差异,但其在光合和呼吸电子传递链中都发挥着类似的氢醌:电子受体氧化还原酶的功能。ACIII复合体由8个蛋白质亚基(ActA、ActB、ActC、ActD、ActE、ActF)组成,共包含25段跨膜螺旋。在膜周质侧,ActA和Act E共结合6个c型血红素,ActB结合1个[3Fe-4S]簇和3个[4Fe-4S]簇,这些血红素和铁硫簇共同构成了ACIII的电子传递链。ActE是一种可溶的亚基,作为ACIII复合体内最终的电子受体。ActC亚基包含一个醌结合口袋和一条质子转运通道。尽管目前已有2个呼吸态(F. johnsoniae、R. marinus)和2个光合态(R. castenholzii、C. aurantiacus)ACIII的冷冻电镜结构被报道,但冷冻电镜与X射线晶体学这两种结构解析技术对ACIII构象的影响仍不清楚。
(三)图文导读
为了回答上述问题,继2024年在The Plant Cell期刊报道了C. aurantiacus光合态ACIII(CaACIIIp)天然状态2.9-Å和结合抑制剂HQNO的2.7-Å分辨率的冷冻电镜结构后,研究人员解析了CaACIIIp在3.2-Å分辨率的晶体结构。通过与冷冻电镜结构的比对,发现溶剂暴露区域的亚基ActB、ActD、ActG以及远离复合体中心的跨膜亚基出现了局部构象变化;而核心功能模块,如醌结合口袋、氧化还原中心和质子转运通道的构象保持不变,从而维持了酶的整体活性。
此外,研究人员分析了晶体结构和冷冻电镜结构的B因子(B-factor),发现两种方法解析的结构在边缘区域(无论是跨膜区还是可溶区)均展现出较高的B因子,尤其与结构核心区域相比。值得注意的是,晶体结构的B因子整体高于冷冻电镜结构。通过比对不同物种ACIII的氨基酸序列,发现B因子较高的结构区域比B因子较低的区域保守性更低,且构象变化较大的亚基界面的保守性也低于构象变化较小的亚基界面。此外,ActB、ActD、ActG及亚基I在与冷冻电镜结构相比显示出局部构象变化的区域,同样表现出较低的序列保守性。
(四)作者简介
第一作者:
吴文萍,博士,杭州师范大学基础医学院讲师
通讯作者:徐晓玲
徐晓玲,教授,博士生导师,中国生物物理学会光生物物理专业委员会委员。综合运用生物化学、生物物理和合成生物学方法,研究电子传递链和细胞能量代谢过程中重要生物大分子的结构和功能,开展以结构为基础的蛋白质分子设计,探索其在生物固碳、绿色化工和医药领域的应用。近年来在Science Advances、Nature Communications、The Plant Cell、mBio等期刊发表研究论文40篇,主持国家自然科学基金项目5项,浙江省自然科学基金杰出青年项目等多课题,现任Communications Biology期刊编委。