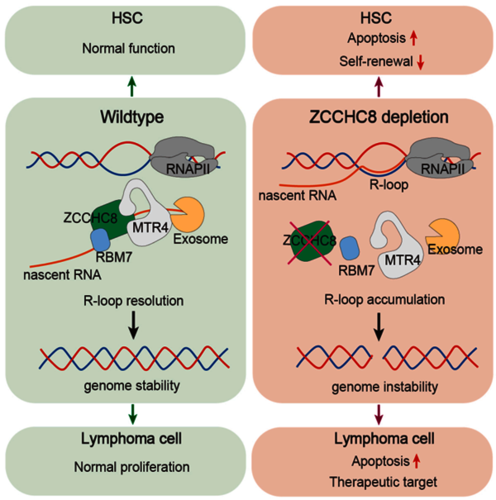
造血干细胞(hematopoietic stem cell, HSC)通过自我更新和多系分化维持机体终身造血功能。为维持其长期再生潜能,HSC 必须在生命周期中保持基因组稳定性,否则可能导致造血功能障碍甚至恶性血液疾病。哺乳动物基因组中广泛存在的转录过程会产生大量无功能新生转录本,进而形成 R 环(R-loop)——一种由 RNA-DNA 杂合链和游离单链 DNA 组成的三链结构。R 环若未被及时清除,可引发转录偶联的 DNA 断裂,严重威胁HSC的基因组稳定性和其长期再生能力。因此,及时清除无功能的新生转录本、预防R环积累,对维持HSCs功能至关重要,但其分子机制尚不明确。
2025年12月,杭州师范大学基础医学院汪虎课题组联合同济大学高亚威团队、暨南大学鞠振宇团队在 Cell Reports 上发表了题为 “Nuclear exosome targeting complex safeguards hematopoietic stem cell self-renewal and genomic integrity through resolving R loops” 的研究论文。该研究聚焦于核外切体靶向复合物(Nuclear exosome targeting complex, NEXT),该复合物由 MTR4、RBM7 和 ZCCHC8 三个核心亚基组成,能够识别并将无 poly(A) 尾的非功能新生转录本导向 RNA 外切体进行降解。该研究揭示,NEXT 通过抑制转录耦链的R 环形成,从而在HSC中扮演基因组守护者的关键角色。
研究人员发现,在多种细胞中敲低 ZCCHC8(NEXT复合物的核心支架蛋白)会导致R环积累、DNA损伤加剧和细胞凋亡增加。为探究其在造血系统中的生理功能,团队构建了造血特异性 Zcchc8敲除小鼠模型。尽管稳态条件下Zcchc8缺陷小鼠的外周血象和短期造血未见异常,但其骨髓中HSC的数量显著下降,且这些干细胞在竞争性移植实验中表现出明显的自我更新能力和重建功能受损。进一步机制研究表明,Zcchc8敲除HSC中的R环水平显著上升,并伴随着DNA双链断裂增加和细胞凋亡加剧。过表达可降解RNA-DNA杂交链的RNase H1可有效挽救这些 DNA 损伤表型,证明R环积累是导致基因组不稳定的主要原因。转录组测序分析亦显示,Zcchc8敲除HSC中的DNA损伤应答与修复通路基因普遍上调,提示细胞正持续应对未修复的DNA损伤。
除了在正常造血中的保护作用,研究还发现ZCCHC8在弥漫性大 B细胞淋巴瘤(DLBCL)中频繁高表达,且其高表达与患者不良预后显著相关。在 DLBCL 细胞系中敲低ZCCHC8 可抑制细胞增殖、增加 R 环和 DNA 损伤并促进凋亡,而这些效应同样可被 RNase H1 过表达所逆转,说明 ZCCHC8 通过调控 R 环维持淋巴瘤细胞的存活。
综上所述,该研究不仅揭示了NEXT复合物通过清除R环以维护造血干细胞基因组稳定性和长期自我更新的新机制,还发现其在DLBCL中高表达并与不良临床预后相关,为 DLBCL 的治疗提供了新的潜在靶点。
该研究受国家重点研发计划、国家自然科学基金、浙江省自然科学基金、杭师大科研登峰工程等项目的资助。杭州师范大学汪虎教授、吴爱伟博士、同济大学高亚威教授、暨南大学鞠振宇教授为共同通讯作者。汪虎教授团队青年教师潘应昊、左洪娜为共同第一作者。
原文链接:https://doi.org/10.1016/j.celrep.2025.116650