第一作者:张孟,付莹莹,杨晓强,覃秋莹
通讯作者:徐勇昌、阮陟
发表期刊:Advanced Science
期刊5-Year Impact Factor:15.6
通讯单位:杭州师范大学基础医学院
论文DOI: https://doi.org/10.1002/advs.202510491
成果简介
2025 年 12 月 12 日,基础医学院徐勇昌副教授联合浙江大学医学院附属邵逸夫医院阮陟研究员团队,在《Advanced Science》发表题为 “Balanced Expression of the Diiron Oxygenase BioE Is Essential for Biotin Homeostasis in Elizabethkingia meningoseptica” 的研究论文。该研究通过系统发育分析发现,BioE在各类细菌中分布广泛,即便在缺乏同源阻遏因子 BioL 的专性细胞内衣原体中亦有存在。深入研究揭示,脑膜败血伊丽莎白菌的 EmBioE 以同源二聚体形式存在,可识别酰基-ACP/CoA;而鹦鹉热衣原体(Chlamydia psittaci)的 CpBioE 为单体,仅特异性结合酰基-ACP。在伊丽莎白菌中,BioL 的缺失会导致 EmBioE 途径的失控,进而耗尽长链脂肪酸及 ATP/SAM 代谢池,这是其产生生物素营养缺陷的关键诱因。该研究证实,BioE 的平衡表达对细菌存活至关重要,为多重耐药病原体的抗菌药物研发提供了全新靶点。
引言
生物素作为水溶性必需维生素,是脂肪酸衍生物及多种代谢酶的辅基,通过翻译后修饰调控脂肪合成、糖异生及氨基酸的关键酶。如脂肪酸合成的关键步骤乙酰辅酶 A 羧化酶。由于哺乳动物无法从头合成生物素,因此细菌生物素合成途径的关键酶已成为结核分枝杆菌、鲍曼不动杆菌等病原体治疗的潜在抗菌靶点。
生物素合成分为早晚期阶段,晚期阶段由 BioF、BioA、BioD、BioB 等保守酶介导,而前体庚二酰—CoA/ACP 的合成则呈现显著物种多样性,目前已发现三条核心途径:大肠杆菌的 BioC-BioH 途径、枯草芽孢杆菌的 BioI-BioW 途径以及农杆菌的 BioZ 途径。本团队近期在多重耐药伊丽莎白菌属和金黄杆菌属中鉴定出第四条途径—BioE 依赖型途径,BioE 作为非血红素双铁加氧酶,可催化长链酰基底物裂解生成庚二酰产物,由 MocR 家族转录因子 BioL 通过感知中间产物 AON 负向调控,形成独特的代谢反馈机制(徐勇昌等, PNAS, 2025)。并基于结构的虚拟筛选发现小分子 466982 为高效 EmBioE 抑制剂,对伊丽莎白菌具有剂量依赖性抗菌活性。
本研究不仅拓展了生物素合成途径的物种多样性与调控机制认知,明确了 BioE 蛋白在不同细菌中的功能分化特征,更验证了其作为抗菌靶点的临床应用潜力。该发现为多重耐药伊丽莎白菌属等难治性病原体感染的治疗提供了全新思路,同时为生物素绿色生物合成技术的开发奠定了理论基础。
图文导读
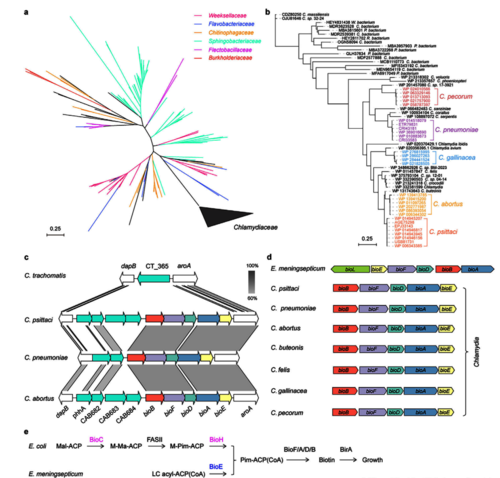
BioE 介导的生物素合成途径最初发现于 Weeksellaceae 科的伊丽莎白属、金杆菌属等医院病原菌中。我们以 EmBioE 为模板,在 NCBI 数据库中筛选后分析显示:BioE 除了广泛分布于 Weeksellaceae、黄杆菌科等多个科外,也存在于衣原体科的寄生菌种中。
对衣原体科进行研究发现其多数菌种均含有 BioE,但沙眼衣原体除外;比较基因组分析表明,沙眼衣原体天然缺失生物素合成基因簇。对比 7 种衣原体与脑膜败血伊丽莎白菌的遗传背景,衣原体属虽保守生物素合成基因簇,但缺少转录调控因子 BioL。对 8 种衣原体的分析显示:宿主为人类/啮齿动物的物种(如沙眼衣原体),因宿主可提供充足生物素,从而天然丢失了生物素合成簇,仅保留 BioY 转运途径;同时所有衣原体均保留 FAS II 脂肪酸合成途径(既依赖生物素,也产其合成底物),提示其生物素合成的遗传特征与宿主环境密切相关。克隆鹦鹉热衣原体的 CpBioE,通过异源互补实验证实:CpBioE 与 EmBioE 类似,可在大肠杆菌中替代经典的 BioC-BioH 途径。综上,BioE 生物素合成途径在多个类群中兼具遗传保守性与多样性。
图1 BioE 分布的遗传多样性
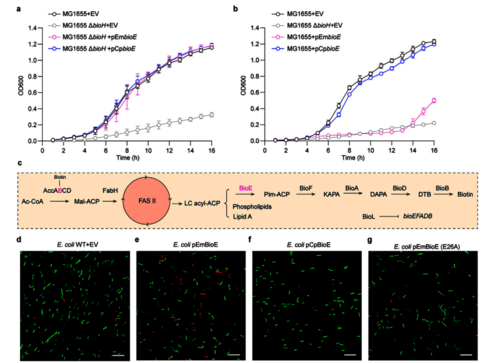
我们通过对大肠杆菌 ΔbioH 回补 CpBioE 后,发现其可以恢复在无生物素的 M9 培养基中的生长;但在野生型大肠杆菌中,仅 EmBioE 过表达则会引发生长迟缓,类似 BioC 高表达对脂肪酸合成的干扰效应。通过共聚焦显微镜的活/死染色结果显示:EmBioE 的过表达,细菌的死亡细胞(红色)显著增加,而 CpBioE 或无催化活性的 EmBioE(E26A)过表达无此影响。本研究明确:伊丽莎白菌 EmBioE 与衣原体 CpBioE 的结构、生化特征存在差异,体现 BioE 家族的遗传多样性:EmBioE 兼具促生物素合成以维持生长、过表达引代谢适应成本的双重作用,需 BioL 调控以平衡生物素合成与脂代谢;衣原体因 CpBioE 低活力且底物专一性丢失 BioL,减少脂代谢扰动。
图2 EmBioE的过表达对宿主的代偿机制
综上所述,本研究以生物素合成这一经典而关键的细菌代谢通路为切入点,系统揭示了 BioE 依赖型生物素合成途径在不同细菌类群中的遗传多样性、功能分化及其精细调控机制,首次阐明了 BioL–BioE 轴,通过维持代谢稳态来保障细菌生存的核心生物学意义。该研究不仅深化了对细菌代谢网络协调与进化适应机制的认识,也突破了传统将生物素合成视为“单向必需通路”的认知框架,揭示其潜在的代谢代价与调控约束。更重要的是,研究从基础机制层面验证了 BioE 作为抗菌靶点的可行性,为开发靶向细菌代谢稳态、区别于现有抗生素作用模式的新型抗感染策略提供了坚实的理论基础。该成果在应对多重耐药病原体感染、拓展抗菌药物研发新方向以及推动生物合成技术应用等方面均具有重要的科学意义和潜在应用价值。
第一作者:张孟(2022级基础医学院硕士,左四,现就读复旦大学博士研究生),付莹莹(右二,拟录取南开大学博士研究生),杨晓强(左三),覃秋莹(左四)
参与作者:苏鑫昱(左二),方嘉明(右一),康艳华(杭州师范大学基础医学院老师),何清雯(同济大学附属东方医院主管技师)
通讯作者:徐勇昌副教授(右四),阮陟研究员
基础医学院硕士研究生张孟、付莹莹、杨晓强和覃秋莹为共同第一作者,基础医学院徐勇昌副教授和浙江大学医学院附属邵逸夫医院阮陟研究员为共同通讯作者。杭州师范大学基础医学院康艳华老师,同济大学附属东方医院主管技师何清雯为本论文做出重要贡献。杭州师范大学为本文的第一完成单位。该研究受到国家自然科学基金以及杭州师范大学人才科研启动经费的支持。