第一作者:沈洁洁、吴文萍
通讯作者:徐晓玲
发表期刊:mBio
期刊 5-Year Impact Factor:6.9
通讯单位:杭州师范大学 基础医学院
论文DOI:10.1128/mbio.03414-23
(一)成果简介
2024年4月4日,杭州师范大学基础医学院徐晓玲课题组在微生物学领域权威期刊mBio(中科院升级版一区TOP期刊)上在线发表了题为“Chloroflexus aurantiacus acetyl-CoA carboxylase evolves fused biotin carboxylase and biotin carboxyl carrier protein to complete carboxylation activity”的研究成果。文章首次揭示了异质型乙酰辅酶A羧化酶(ACC)一种新的亚基组装方式和作用机制。这种来自光合绿丝菌(Chloroflexus aurantiacus)的ACC通过融合生物素羧化酶(BC)和生物素羧基载体蛋白(BCCP),与生物素羧基转移酶CTα和CTβ直接结合,组装成的复合酶在体外将乙酰辅酶A(Ac-CoA)羧化为丙二酰辅酶A(M-CoA),并在重组的大肠杆菌细胞内与丙二酰辅酶A还原酶(MCR)共同催化高附加值化学品3-羟基丙酸(3-HP)的合成。
(二)引言
ACC广泛存在于动物、植物和微生物中,催化乙酰辅酶A(Ac-CoA)羧化为丙二酰辅酶A(M-CoA),是生物体内脂肪酸合成的关键限速酶。根据结构和来源,ACC可分为同质型和异质型。同质型ACC主要存在于真核生物,在同一条肽链上依次分布生物素羧化酶(BC)、生物素羧基载体蛋白(BCCP)和羧基转移酶(CT)三个功能结构域,结构较为稳定。异质型ACC主要存在于原核生物、古细菌和部分植物,由不同基因编码的BC、BCCP、CTα和CTβ亚基组成多酶复合体,稳定性较差。在ACC催化的反应中,BC、BCCP和CT既各司其职,又协同完成两步独立的半反应:在BC的催化作用下,BCCP连接的生物素被羧化为中间体BCCP-biotin-CO2-;在CTα和CTβ的共同催化下,CO2-从BCCP-biotin转移到Ac-CoA,使之转变为M-CoA。
由于异质型ACC的亚基由不同的基因编码,复合酶的稳定性差。目前还没有异质型ACC完整复合酶结构的报道,仅有来自于细菌ACC单个亚基的结构。特别的是,异质型ACC在不同物种中所含有的亚基数目和组合方式都存在着差异,造成其结构和催化机制的多样性。例如,大肠杆菌的ACC由完全分离的BC、BCCP、CTα和CTβ亚基组成;嗜热金属球菌的BC和BCCP分离,而CTα和CTβ融合。在天蓝色链霉菌和结核分枝杆菌中,BC和BCCP融合形成α亚基,CTα和CTβ则融合形成β亚基,还有一种特殊的ε亚基辅助增强ACC的催化活性。尽管目前已发现了多种异质型ACC的亚基组合方式,但BC和BCCP融合,而CTα和CTβ分离的异质型ACC从未被报道。
近期,徐晓玲课题组在一种非常古老的细菌——光合绿丝菌(Chloroflexus aurantiacus)中发现了一种新的异质型ACC,催化“3-羟基丙酸(3-HP)循环”的第一步反应,在二氧化碳的固定和脂肪酸合成中都发挥着关键作用。这种ACC通过融合的BC和BCCP直接结合CTα和CTβ,组装出的复合酶在体外转化Ac-CoA为M-CoA,并在重组的大肠杆菌细胞内与丙二酰辅酶A还原酶(MCR)共同催化高附加值化学品3-HP的合成。
(三)图文导读
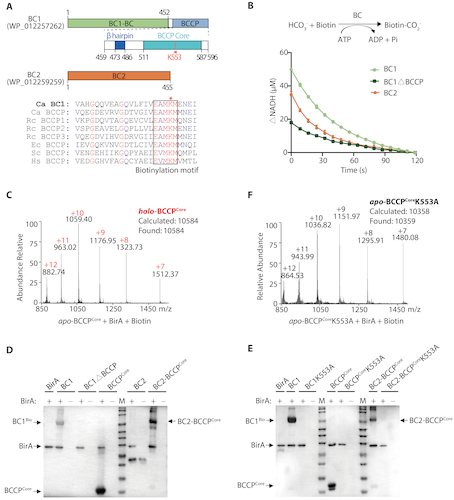
研究人员从光合绿丝菌(Chloroflexus aurantiacus)的基因组中发现了2个BC的异构体,分别命名为BC1和BC2(图1A)。序列比对和保守结构域分析显示,BC1的C末端含有一段约150个氨基酸的肽段,与结核分枝杆菌等含有的biotin/lipoyl结构域高度相似,序列与BCCP含有的生物素化基序(E550AMKM554)高度保守。因此,将此肽段命名为BCCP。酶活实验显示,BC1、BC2和突变体BC1ΔBCCP都具有催化生物素羧化的活性(图1B)。为了验证BCCP的催化活性,研究人员通过HPLC-MS和HRP-DAB显色反应发现:BC1、单独的BCCP、嵌合蛋白BC2-BCCP都能被来自于大肠杆菌和光合绿丝菌的生物素连接酶(Biotin ligase,BirA)修饰而发生生物素化。然而,缺失BCCP的BC1突变体、BC2,以及Lys553突变后的BC1、BCCP、BC2-BCCP都不能被BirA生物素化(图1C-F)。由此证实了BC1通过融合BC和BCCP,可同时发挥生物素羧化酶和生物素羧基载体蛋白的双重催化活性;而BC2仅发挥生物素羧化酶活性。
图1 光合绿丝菌BC1是融合了BC和BCCP的双功能酶。
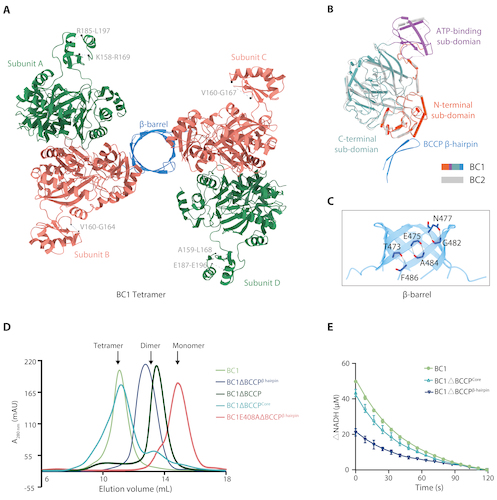
为了揭示BC1和BC2的催化活性与结构之间的关系,研究人员解析了BC1四聚体(图2A)和BC2二聚体的晶体结构。两个结构在BC区域高度相似,都含有N-端、ATP结合和C-端结构域。特别的是,从BC1的晶体结构中首次看到了BCCP N端两个反平行β折叠的构象(图2B)。4个β折叠通过氢键相互作用交错形成一个β桶,将两个BC1-BC同源二聚体组装为四聚体(图2A和C)。分析超速离心(AUC)、凝胶过滤层析和酶活实验显示,破坏形成β桶的氢键相互作用后,BC1的四聚体解离为二聚体,同时其生物素羧化酶的活性出现下降(图2D和E)。因此,融合的BCCP在BC1形成四聚体和发挥生物素羧化酶活性中都发挥着关键作用。
图2 光合绿丝菌BC1的晶体结构、聚集形式和酶活检测。
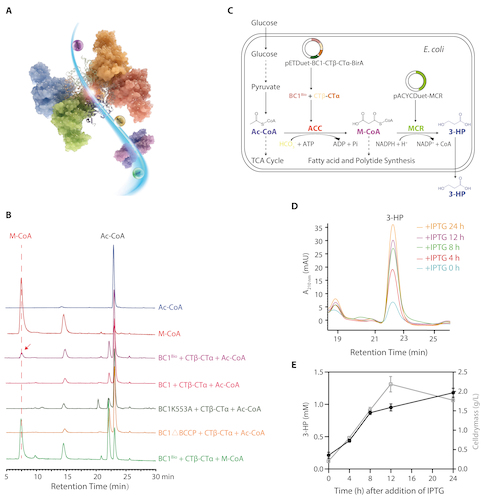
通过蛋白质互作实验,研究人员进一步证实了融合的BCCP还介导BC1与CTβ-CTα的直接相互作用,在溶液中可组装成完整的复合酶。在体外实验中,此复合酶可催化碳酸氢根和Ac-CoA生成M-CoA(图3A和B)。在大肠杆菌细胞中共表达BC1、CTβ-CTα和MCR后,可在24小时的培养时间内检测到3-HP的合成量逐渐增加(图3C-E)。基于上述结构和生化分析,研究人员最终证实,BC1通过融合BC和BCCP,与CTβ-CTα组装成一个有活性的异质型ACC,在体外和重组的大肠杆菌细胞内都具有催化Ac-CoA羧化为M-CoA的活性。
图3 光合绿丝菌ACC在体外和重组大肠杆菌细胞中的活性检测。
综上所述,本研究发现了异质型ACC一种新的亚基组装方式和作用机制,构建了基于丙二酰辅酶A途径合成3-HP的工程菌株,为3-HP的高效绿色合成提供了新的思路和理论基础。
(四)作者简介
第一作者:沈洁洁(前排右一)、吴文萍(二排右一)
参与作者:硕士生王康乐(三排左二)、吴婧怡(前排右三)、副教授刘兵(二排左三)、硕士生李春阳(二排右二)、龚紫郡(前排左三)、洪鑫(二排左二)、方函(前排左二)、附属医院张邢炜院长参与了本文的研究内容。
通讯作者:徐晓玲(前排中间)
徐晓玲,教授,博士生导师,清华大学博士,美国Scripps研究所博士后,入选浙江省特殊支持计划青年拔尖人才、“院士结对培养青年英才”等。综合运用生物化学、生物物理和合成生物学方法,研究电子传递链和细胞能量代谢过程中重要生物大分子的结构和功能,开展以结构为基础的蛋白质分子设计,探索其在生物固碳、绿色化工和医药领域的应用。近年来在Science Advances、Nature Communications、eLife、The Plant Cell等期刊发表研究论文36篇,主持国家自然科学基金项目4项,浙江省自然科学基金杰出青年项目等多项课题,现任Communications Biology期刊编委。
论文链接:https://journals.asm.org/doi/10.1128/mbio.03414-23