2025年1月1日,杭州师范大学汪虎教授团队联合天津医科大学艾玎教授团队和首都医科大学附属北京安贞医院蒋宏峰教授团队在心血管领域权威期刊Circulation Research(中科院一区Top,2024年影响因子为16.5,近5年平均影响因子为20.3)发表题为‘BRISC-Mediated PPM1B-K63 Deubiquitination and Subsequent TGF-β Pathway Activation Promote High-Fat/High-Sucrose Diet–Induced Arterial Stiffness’的研究论文,揭示了PPM1B的去泛素化调控机制,为动脉硬化的治疗提供了新的靶点。
动脉硬化是一种以动脉壁过度纤维化、钙化和胶原沉积为特征的病理状态,这些变化导致血管弹性降低和硬度增加。它不仅是多种心血管疾病的独立危险因素,也是代谢综合征患者发展为心血管疾病的主要诱因。因此,深入研究糖脂代谢紊乱如何诱导动脉硬化的机制,对于降低代谢综合征患者的心血管疾病风险和开发新的治疗策略具有重要的指导意义。
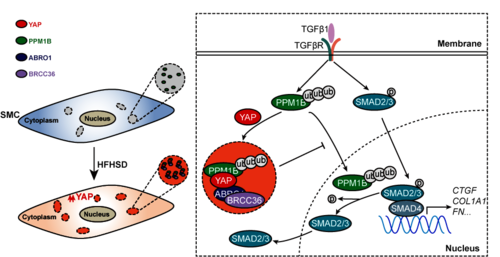
在本项研究中,研究者利用携带平滑肌特异性启动子的AAV(AAV9-SM22α)构建了模型小鼠,这些小鼠的平滑肌细胞特异性过表达了野生型PPM1B和泛素化位点突变型PPM1B,以及相应的对照组。研究发现,PPM1B通过K326位点依赖的K63泛素化途径,改善了高脂高糖饮食诱导的动脉硬化。在机制探索方面,研究者采用高内涵筛选和蛋白质组学相结合的方法,筛选出BRISC去泛素化酶复合体,并运用蛋白质免疫共沉淀、GST-pulldown、蛋白纯化和体外成像等分子生物学技术,揭示了PPM1B-YAP-ABRO1复合体能够形成液-液相分离,促进PPM1B的去泛素化过程。进一步,研究者构建了平滑肌特异性的ABRO1敲除和BRCC36敲除小鼠模型,并给予高脂高糖饮食以诱导动脉硬化。结果显示,与对照组相比,ABRO1和BRCC36的敲除显著改善了小鼠的血管硬度和胶原沉积。这项研究通过动物实验和细胞分子生物学技术,阐明了YAP协同BRISC对PPM1B去泛素化的调控机制,并指出靶向BRISC可能减轻代谢综合征相关的动脉硬化,为代谢综合征患者的心血管并发症治疗提供了潜在的新靶点。
杭州师范大学博士后刘亚楠、天津医科大学在读博士生陈志鹏和天津医科大学基础医学研究中心科研平台技术员李梦珂为该论文的共同第一作者;天津医科大学艾玎教授、杭州师范大学汪虎教授和首都医科大学附属北京安贞医院蒋宏峰教授为该论文的共同通讯作者。
原文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325590