3月25日,我院徐晓玲教授课题组在《美国科学院院刊》上发表题为“Structure of ATP synthase from an early photosynthetic bacterium Chloroflexus aurantiacus”的研究论文,解析了来自绿色非硫细菌Chloroflexus aurantiacus 的F型ATP合酶(CaF1FO)在结合底物前后各三个旋转状态的高分辨率冷冻电镜结构,结合结构分析和催化活性测定,发现了ATP合酶一种全新的亚基组装方式和质子跨膜转运机制。
《美国科学院院刊》Proceedings of the National Academy of Sciences of the United States of America (简称“PNAS”,2024,IF=9.4) ,创刊于1914年,是著名经典综合科学类学术期刊,在学术界有很高的声誉和影响力。
F型ATP合酶(F-type ATP synthase,F1FO)广泛分布于线粒体内膜、叶绿体类囊体膜、异养菌和光合细菌的质膜上。作为细胞能量代谢的发动机,自1960年被发现以来,F1FO的亚基组成、空间结构和作用机制一直是生物学研究的热点。
徐晓玲课题组前期聚焦地球上出现最早的光合细菌——绿色非硫细菌的电子传递和能量代谢机制,系统 揭示了此类细菌光合电子传递链的组成和作用机制(Nat Commun. 2018;Sci Adv. 2020;Photosynth Res. 2020;eLife, 2023;Plant Commun, 2024;Plant Cell, 2024;Structure,2025)。然而,此前学界关于此类细菌的光合电子传递如何驱动ATP合成的分子机制仍不清楚(图1)。
图1 绿色非硫细菌的光合电子传递链和ATP合成(光合磷酸化)
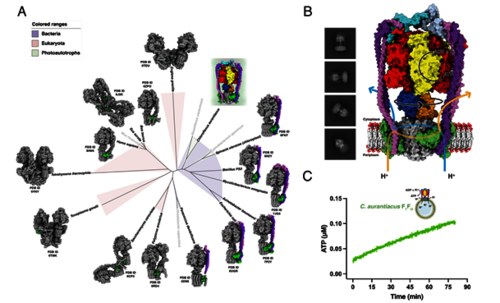
本研究以Chloroflexus aurantiacus为材料,内源分离提取出完整的ATP合酶(CaF1FO),分别解析了结合和不结合底物ADP的样品在三种旋转状态下的高分辨电镜结构,并发现了一种全新的F1FO结构特征和独特的质子跨膜转运机制。与以往报道的所有ATP合酶截然不同,CaF1FO含有2个外周茎(b1b2δ1和b3b4δ2)和2个跨膜转运质子的a亚基(图2)。在旋转催化过程中,2个外周茎为偶联CaF1进动(precession)和c10环的旋转提供了显著的结构稳定性和构象灵活性:2个外周茎中间螺旋区域呈现出不对称的弯曲形态,以防止旋转催化过程中CaF1头部的摆动;在CaF1顶端,2个δ亚基的N端(δ-N)形成二聚体,通过显著的构象变化释放旋转过程中储存的弹性能量。
图2已解析结构的F1FO物种进化树(A),CaF1FO的电镜结构和ATP合成活性(B,C)
最特别的是,2个a亚基在膜周质侧和胞质侧分别形成2个质子入口和2个质子出口,赋予CaF1FO独特的质子跨膜转运机制。在PMF的驱动下,膜周质侧的质子通过入口同时进入a/c10环交界面的2个质子半通道。由于2个“检查点”aArg249和2个质子出口的存在,c10环只需要旋转4个和6个子步骤就可以将质子转运到胞质侧。与仅含有1个a亚基和c10环的ATP合酶相比,CaF1FO的c10环旋转一周可以跨膜转运20个质子并催化3分子ATP的合成(图3)。因此,通过增加a亚基的数目,CaF1FO获得了显著高于传统单个a亚基F1FO的H+/ATP比率,以适应极端环境中光照条件改变所引起的快速PMF变化。
图3 CaF1FO的质子跨膜转运机制
综上所述,本研究解析了首个来自进化早期光合细菌的完整F1FO结构,揭示了一种全新的F1FO亚基组装方式和质子跨膜转运机制。这一发现填补了对光合细菌ATP合酶结构和催化机制研究的空白,全面绘制了丝状不放氧光合细菌光合磷酸化的全景图,将为基于ATP合酶结构的酶改造、靶向药物设计、人工细胞器和仿生系统的设计等提供新思路。
基础医学院2022级生物学博士生张鑫为论文第一作者,徐晓玲教授为唯一通讯作者,我校为第一完成单位和通讯作者单位,清华大学饶子和院士为研究提供了宝贵建议。课题组博士生吴婧怡、洪鑫,硕士生王佳茂、裴鑫楷和硕士毕业生闵真真参与了研究。本研究得到国家自然科学基金、浙江省自然科学基金杰出青年项目和杭州师范大学交叉学科创新研究项目的支持。