生物素(维生素 B7)是含 7 碳骨架的含硫脂肪酸衍生物,作为关键酶辅因子广泛参与糖、蛋白质、脂肪酸的核心代谢过程,其合成与精密调控对微生物生存、代谢稳态至关重要。从进化特征来看,植物、真菌及多数病原细菌可通过 “从头合成” 途径产生生物素,而哺乳动物在进化中丧失该能力,需依赖饮食摄取或肠道菌群供给—这一物种间的代谢差异,使细菌生物素合成途径成为抗菌药物研发的理想靶点。生物素合成的核心瓶颈是庚二酸(pimelic acid)前体的生成,此前科学界仅鉴定出3条细菌庚二酸合成途径:(1)BioC-BioH 途径:最主流的途径,广泛存在于肠杆菌科等 20 余菌属,通过 “劫持” II 型脂肪酸合成(FAS II)通路,经 BioC 催化丙二酰 - CoA/ACP 甲基化、两轮 FAS II 样反应生成庚二酸 - ACP 甲酯,再由 BioH 去甲基化生成庚二酸硫酯;(2)BioI-BioW 途径:仅存在于芽孢杆菌科 / 葡萄球菌科,BioI(细胞色素 P450 样酶)切割长链酰基 - ACP 的 C7-C8 键生成庚二酸 - ACP,BioW 则作为庚二酸 - CoA 合成酶激活外源性庚二酸;(3)BioZ 途径:限于 α- 变形菌,BioZ 通过缩合赖氨酸分解产生的戊二酰 - CoA 与脂肪酸合成的丙二酰 - ACP 前体,生成庚二酸 - ACP。然而,伊丽莎白菌(Elizabethkingia)、金黄杆菌(Chryseobacterium)等临床多重耐药菌,既缺乏上述经典合成途径的核心基因,但却能自主合成生物素。其庚二酸合成机制长期未被阐明,成为该领域的关键科学缺口。同时,此类致病菌常引发医院获得性肺炎、脑膜炎、败血症等难治性感染,且普遍对多黏菌素、碳青霉烯类等“最后一道防线类”抗菌药物高水平耐药,传统抗菌策略收效甚微,亟需挖掘新的治疗靶点。
2025年12月5日,基础医学院徐勇昌副教授联合浙江大学医学院冯友军教授、浙江大学医学院附属邵逸夫医院阮陟研究员,以及美国宾州州立大学 J. Martin Bollinger Jr.教授等团队在PNAS期刊发表了题为“A ferritin-like diiron oxygenase BioE initiates bacterial biotin synthesis, a promising anti-virulence target”的研究论文。该研究通过对 KEGG 数据库中所有细菌的全基因组比较分析,在伊丽莎白菌/金黄杆菌的生物素操纵子,负责生物素合成下游步骤邻近区域,鉴定出2个全新基因:bioE(编码铁蛋白样非血红素双铁加氧酶)和bioL(编码 MocR 型双功能转录因子),并证实二者共同构成了一条全新的庚二酸合成途径。
图1 比较基因组学分析挖掘新型BioE-BioL生物素合成途径
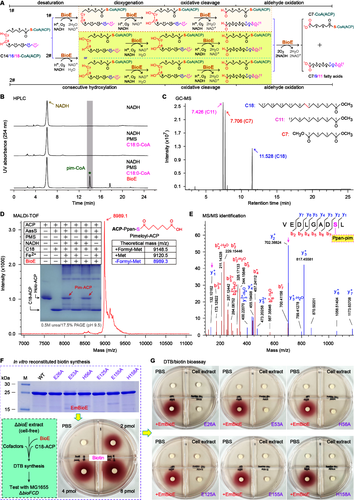
BioE 属于铁蛋白样非血红素双铁加氧酶(FDO)家族,与蓝细菌醛脱甲酰加氧酶(cADO)氨基酸序列同源性约 20%,但催化功能完全不同,是该途径的核心执行元件。BioE仅识别并切割 C14(肉豆蔻酰)、C16(棕榈酰)、C18(硬脂酰)长链脂肪酸酰基辅酶 A(CoA)或酰基载体蛋白(ACP)底物,对 C12(月桂酰)底物无催化活性;通过 10 电子氧化反应特异性切割底物的 C7-C8 碳键,生成庚二酸 - CoA/ACP(生物素合成关键前体)和 Cn-7 游离脂肪酸(如硬脂酰 - CoA 切割生成庚二酸 - CoA 和十一烷酸)。该反应依赖氧气和 NADH / 吩嗪硫酸甲酯(PMS)还原系统,核心是双铁辅因子介导的氧化裂解 ——ICP-MS 证实 BioE 单体可结合近 2 个铁离子,E26、E53、H56、E125、E155、H158 等残基为铁离子关键结合位点,任一残基突变都会导致铁结合能力丧失、酶活性完全消失;AlphaFold/SWISS-MODEL 建模显示,BioE 为同源二聚体,具有 FDO 家族保守的 “四螺旋束” 结构,底物结合口袋精准适配长链脂肪酸链。
图2 BioE 蛋白的基本生化特征
通过体外生化实验,进一步确证BioE催化的活性与产物:HPLC 检测到 BioE 与硬脂酰 - CoA 反应生成庚二酸 - CoA 特征峰,GC/MS 证实甲基化产物为庚二酸二甲酯和十一烷酸甲酯;MALDI-TOF MS/MS 进一步验证硬脂酰 - ACP 底物生成庚二酸 - ACP(分子量 8989.1 Da),且该反应依赖氧气和还原系统,厌氧条件下无产物生成;无细胞合成系统中,补充纯化 BioE 的大肠埃希菌 ΔbioH 或伊丽莎白菌 ΔbioE 细胞提取物,可支持生物素缺陷型大肠埃希菌 ΔbioFCD 的生长,证实该途径可独立完成生物素前体(脱硫生物素/DTB)合成。
图3 BioE酶的催化机制
本研究首次发现介导细菌生物素合成的新途径,填补了 Weeksellaceae 科细菌(伊丽莎白菌/金黄杆菌)生物素合成机制的空白;同时揭示了 FDO 家族酶的催化多样性—不同于经典 cADO 的醛脱甲酰反应,BioE 通过氧化裂解长 链脂肪酸生成 7 碳前体,为深入阐明非血红素双铁加氧酶的功能演化机制提供新范式。
BioE 为伊丽莎白菌/金黄杆菌等致病菌特有,哺乳动物无同源蛋白,靶向 BioE 不会产生宿主毒性,规避了传统抗生素的脱靶风险;抑制 BioE 可阻断致病菌生物素合成,既削弱其毒力(生物膜形成、宿主定植能力下降),又不直接杀菌,不易诱导耐药性,符合 “抗毒力” 抗菌策略的发展方向。当前临床常用喹诺酮类药物(环丙沙星、左氧氟沙星)治疗伊丽莎白菌/金黄杆菌感染,联合 BioE 抑制剂可增强疗效,为多重耐药菌感染的治疗提供新思路。
我院徐勇昌副教授、硕士研究生张孟、付莹莹、杨晓强为共同第一作者,徐勇昌副教授、浙江大学医学院冯友军教授、浙江大学医学院附属邵逸夫医院阮陟研究员以及美国宾州州立大学 J. Martin Bollinger Jr.教授为共同通讯作者。杭州师范大学基础医学院康艳华老师为本论文做出重要贡献。杭州师范大学为本文的第一单位。